Preventie
De moderne geneeskunde begint meer en meer een preventieve geneeskunde te worden. Ook inzake borstkanker is hier de laatste jaren, met de ontdekking van het BRCA-gen, een shift gekomen naar preventie. Ondertussen zijn meerdere genen ontdekt alsook meerdere risicofactoren beschreven. Afhankelijk van beide kan een gepersonaliseerde screeningsstrategie gekozen worden. Het is daarom belangrijk om deze risico- en genetische factoren te begrijpen.
Diagnose
Ik kreeg de diagnose kanker... Deze website is een portaal die u en uw naasten zal helpen om persoonlijke informatie en antwoorden te vinden voor uw probleem.
Deze website moet een houvast en steun zijn voor patiënten op weg naar herstel en een beter leven.
Het "Diagnose" gedeelte van onze website is opgesteld in twee belangrijke delen. Ten eerste zorgen we in "Anatomie en Fysiologie" voor een basiskennis van de borst. In het tweede deel "Tumoren en aandoeningen" gaan we dieper in op alles wat met aandoeningen van de borst te maken heeft.
Verder wensen wij vrouwen te informeren die zich afvragen of zij wel een borstprobleem hebben, maar daarvoor nog niet onmiddellijk hun arts willen consulteren. Kennis en informatie kunnen dikwijls een onmiddellijke geruststelling betekenen indien de vrouw zelf in staat is het probleem te onderkennen en inziet dat hier geen specifieke behandeling voor noodzakelijk is. Anderzijds trachten we ook vrouwen te informeren bij wie wel degelijk een ernstig borstprobleem is vastgesteld, zoals bijvoorbeeld een kwaadaardige aandoening, en die goed voorbereid naar hun arts willen stappen.
Behandeling
Bij de behandeling van een borstkanker hoort meteen ook een keuze gemaakt te worden rondom de reconstructie. Er is geen fundamenteler doel van onze Stichting dan deze awareness bij de patiënten en oncologische chirurgen te brengen. Door vooraf een geïnformeerde beslissing te nemen, blazen we geen bruggen op voor een latere reconstructie zonder hierbij het oncologische aspect uit het oog te verliezen. Uiteraard primeert de overleving en zal de beslissing van de oncologische chirurg altijd voorgaan.
Op de pagina "Beslissen" staat alle informatie die u kan verwachten tijdens een eerste consultatie alvorens u de tumor laat verwijderen. Deze pagina is zeer uitgebreid en uw plastisch chirurg zal enkel die informatie vermelden die voor uw persoonlijke situatie toepasbaar is.
"Verwijderen van de tumor" vertelt het verhaal van de operatie zelf. Dit is de belangrijkste operatie want een goede wegname van de tumor is en blijft het belangrijkste. We leiden u door de verschillende vormen van wegname. Deze beslissing wordt vaak voor u genomen door een multidisciplinair team van oncologen, radiologen, pathologen, radiotherapeuten, borstverpleegkundigen, gynaecologen, oncologische chirurgen en plastische chirurgen.
In het deel "Borstreconstructie" staat alle informatie en illustratie van de verschillende soorten reconstructie met bijhorende stappen.
Revalidatie
Wie behandeld is voor kanker heeft vaak een lange periode nodig om te herstellen.
Kanker is een ingrijpende ziekte met een zware behandeling. Vaak kampen mensen nadien met psychosociale en/of lichamelijke problemen zoals stress, angst, extreme vermoeidheid, pijnlijke gewrichten, een verminderde conditie, lymfoedeem… Dit kan een grote invloed hebben op het algemeen welzijn.
Er zijn revalidatieprogramma’s die worden aangeboden door de meeste ziekenhuizen. We behandelen hier een aantal grote thema’s.
Quality of life
De levenskwaliteit is een belangrijke factor bij het omgaan met borstkanker. Daarom is het belangrijk om coping-mechanismen te vinden die werken, en die zullen van patiënt tot patiënt verschillen. Voor sommigen kan dat zijn: plezier vinden in activiteiten die zij voor de diagnose deden, tijd nemen om te genieten, vrijwilligerswerk doen, lichaamsbeweging... Van het grootste belang is dat studies hebben aangetoond dat het accepteren van de ziekte als een deel van iemands leven een sleutel is tot effectieve verwerking, evenals het focussen op mentale kracht om de patiënt in staat te stellen verder te gaan met het leven. In dit gedeelte behandelen we enkele onderwerpen die patiënten tijdens en na de behandeling ervaren en geven we informatie om deze aan te pakken.
Tumoren en aandoeningen van de borst
Inleiding
We hebben dit onderverdeeld in infecties, goedaardige gezwellen en kwaadaardige gezwellen.
Elk gezwel of verandering in de borst, de tepel of de oksel moet verder worden onderzocht. Hiervoor worden volgende onderzoeken gebruikt:
Vooreerst anamnese en klinisch onderzoek
Mammografie, meestal aangevuld met echografie van de borsten
Echografie van de borst: onderscheidt cysten van tumoren. Is meestal het enige onderzoek bij adolescente vrouwen.
MRI van de borsten (magnetische resonantie onderzoek): Bij twijfel zal in een aantal gevallen een bijkomende MRI van de borsten noodzakelijk zijn. Dit onderzoek kan soms meer informatie geven over de aard van het letsel, de lokalisatie of de uitbreiding ervan.
Fijne naald aspiratie of weefselbiopsie, eventueel onder echografische begeleiding: Onder lokale verdoving kunnen een aantal cellen of een weefselstukje uit de tumor worden verwijderd, dat verder microscopisch zal worden onderzocht. Hiermee zal men meestal de diagnose borstkanker kunnen bevestigen.
Bij niet-voelbare gezwellen wordt een harpoendraad geplaatst onder radiografische controle. Deze harpoen blijft ter plaatse wanneer de patiënte naar het operatiekwartier gaat, waar de chirurg het gezwel met de harpoendraad kan verwijderen.
Bij abnormaal vochtverlies uit de tepel zal een galactografie worden uitgevoerd. Hierbij brengt de radioloog door middel van een fijn buisje contraststof in de melkgangen, waarna een mammografie wordt uitgevoerd. Zo kan men de structuur van de melkgangen bestuderen en eventuele abnormale melkgangen lokaliseren.
Bij verlies van tepelvocht kan men wat vocht opvangen op een glazen plaatje, dat verder wordt onderzocht naar de aanwezigheid van abnormale cellen of bloed.
I. Infecties van de borst
Ernstige infectieuze problemen ter hoogte van de borst komen eerder zelden voor. De meest voorkomende vormen van een borst- en/of tepelinfecties vallen onder de volgende categorieën:
periductale mastitis
fistels ter hoogte van de tepel en de borst
zwangerschapsmastitis
zeldzame borstinfecties
A. Periductale mastitis
Infecties zijn dikwijls een gevolg van het opstapelen en stilstaan van melk en andere secreties in de grote melkgangen van de borst. Op dit moment is het niet duidelijk of er eerst een verstopping is in de melkgangen die dan gaan ontsteken. Of dat er zich eerst een ontsteking voordoet die dan de melkgangen dicht duwt. Indien de melk of andere secreties die niet verder naar buiten kunnen, gecontamineerd geraakt met een bacterie, zal de borst infecteren.
Dit leidt tot pijn in de borst, een massa in de borst, tepelverlies, tepelretractie en eventueel in een later stadium tot een echt abces met eventueel een fistel. Soms zijn er klassieke tekenen van roodheid, zwelling en pijn aanwezig ter hoogte van de borst.
De behandeling kan zich in een aantal gevallen beperken tot het geven van antibiotica. Indien er een massa te voelen is en deze bevestigd wordt op mammografie, dient deze massa chirurgisch verwijderd te worden. Alle verdachte letsels moeten bij twijfel verwijderd worden.
B. Fistels van de borst
Een fistel ter hoogte van de borst en/of de tepel is meestal een gevolg van een dieper gelegen abces dat in de richting van de tepel uitbreekt. Infecties en fistels worden dikwijls gezien bij patiënten met een ingetrokken tepel. Chronische ontstekingen rond de tepel leiden ook frequent tot fistels.
De behandeling van een borstfistel bestaat erin om de volledige fistelgang en de abcesholte eerst te identificeren en daarna in zijn geheel weg te snijden. Indien een gedeelte van de abcesholte of de fistelgang achterblijft, is het zeer waarschijnlijk dat een recidief opnieuw optreedt. Langdurige wondzorg en eventueel toedienen van antibiotica is soms nodig.
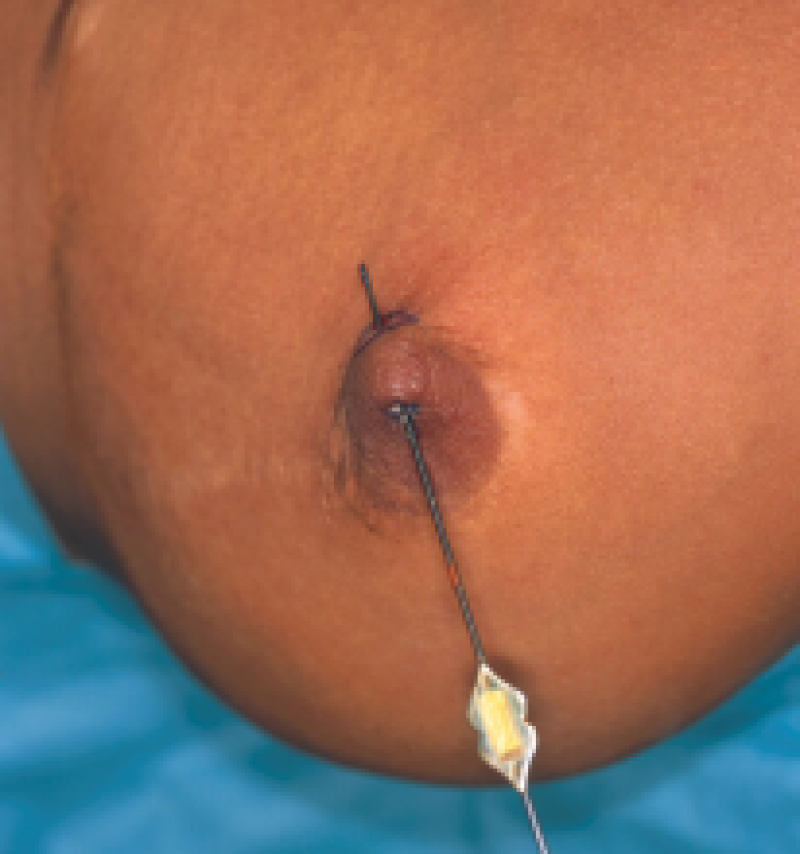
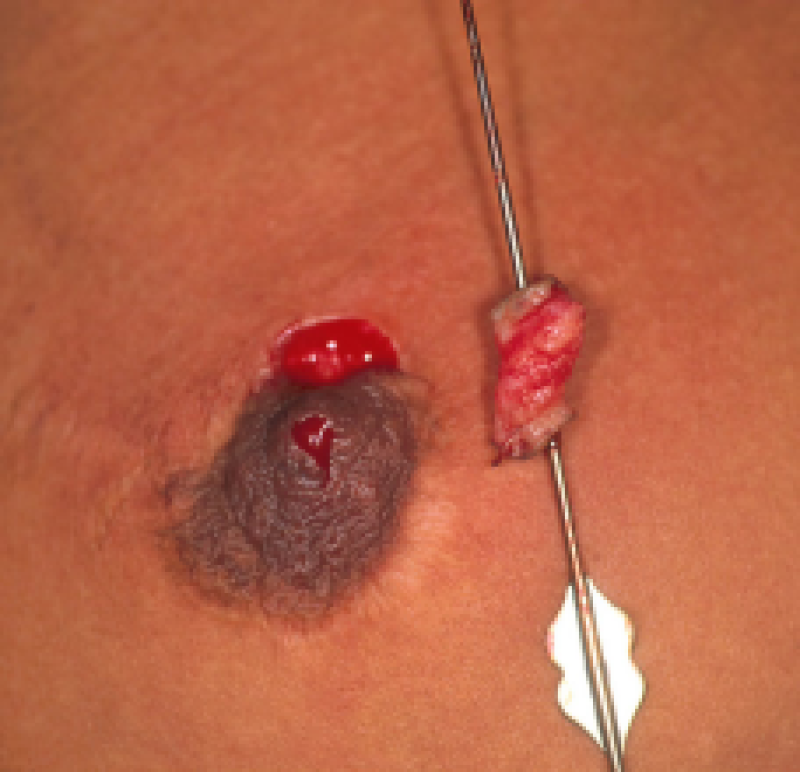
Figuur: een chronische fistel werd ontdekt bij een patiënte die reeds een borstreductie had ondergaan maar geen correctie voor een ingetrokken tepel. Links: na wat zoeken kan onder lokale verdoving de fistelgang gelokaliseerd worden. Rechts: de fistel werd samen met de fistelgang in zijn totaliteit verwijderd.
C. Puerperale of kraambedmastitis
Dit is een aandoening waarbij het vetweefsel rond de borstklieren ontsteekt tijdens de fase van borstvoeding na de bevalling. Ontsteking van dit vetweefsel is te wijten zijn aan een infectie van de moedermelk door de pasgeborene of een borstaspiratietoestel dat werd aangelegd om af te kolven. Typische symptomen van deze aandoening zijn roodheid, zwelling, hardheid en pijn van de borst.
In de meeste gevallen kan deze toestand behandeld worden met antibiotica. Indien de pasgeborene de bron is van de infectie, is het soms noodzakelijk om de borstvoeding te onderbreken.
D. Ongewone borstinfecties
Tuberculose, syfilis, schimmel en andere zeldzame bacteriën kunnen zeldzaam de oorzaak zijn van een ernstige borstinfectie. Deze aandoeningen doen zich vooral voor in onderontwikkelde landen. Het is niet altijd eenvoudig de diagnose te stellen van uitzonderlijke infecties. Dikwijls zijn gespecialiseerde behandelingen noodzakelijk.
II. Goedaardige tumoren
Goedaardige tumoren zijn lokale zwellingen ter hoogte van de borst. Op zichzelf kunnen ze dus geen kwaad maar wanneer het onderscheid met een kwaadaardige tumor niet kan gemaakt worden dient het letsel toch chirurgisch verwijderd te worden. Alhoewel er een zeer grote variëteit bestaat aan goedaardige letsels, komen de hieronder vermelde problemen het meest frequent voor.
A. Fibrocystische aandoening
Deze zwellingen kunnen worden teweeggebracht door opstapeling van vocht in kleinere of grotere cysten (blaasjes). Het beeld past meestal in het kader van een fibrocystische borst of ook nog ziekte van Reclus. Deze aandoening komt voor bij ongeveer een derde van de vrouwen voor de menopauze. Een typische klacht is de zwelling, die soms pijnlijk is, in de tweede cyclus helft. Soms zijn de opstapelingen van vocht beperkt tot microcystische formaties. Soms ontstaan er duidelijk voelbare vochtophopingen die cysten worden genoemd. Wanneer de cysten klein zijn kunnen die na de menstruatie terug in volume afnemen. Grote cysten (tot meerdere centimeters in diameter) kunnen blijven bestaan. Wanneer ze last geven kunnen ze eenvoudig onder echografische geleiding worden leeg gepuncteerd. Wanneer de wand van de cysten geen sterk delende cellen bevat is deze aandoening niet geassocieerd met een verhoogde kans op borstkanker.
B. Uitzetting van de melkgangen
Bij deze aandoening is de melkgang uitgezet en tevens omgeven door ontstekingscellen. Er ontstaat een opstapeling van ingedikt materiaal die in de melkgangen wordt opgestapeld. Dit ingedikt materiaal kan soms via de tepel worden opgemerkt. Na een tijdje zal er bindweefsel worden gevormd. Dit bindweefsel kan de melkgangen dicht knijpen. Dit kan ontsteking en pijn veroorzaken.
C. Fibroadenoom
Dit gezwel komt frequent voor. Fibroadenomen zijn hard en duidelijk begrensd. Ze kunnen bij een ingreep heel eenvoudig worden verwijderd. Ze zijn bij manueel onderzoek zeer beweeglijk. Ze voelen meestal gelobuleerd aan. Fibroadenomen bestaan uit epitheelcellen en bindweefsel. Uitzonderlijk kunnen de fibroadenomen zeer snel groeien.
D. Papillomen
Dit zijn goedaardige tumoren die groeien in de klierbuisjes. Ze ontstaan rond een bindweefselas met centraal bloedvaten. Daarrond gaan epitheelcellen gaan woekeren. De solitaire papillomen ontstaan meestal in één van de grote kanalen onder het tepel complex. Ze kunnen zich voordoen als multipele kleine aanwasjes die meer in de diepte van het borstklierweefsel liggen in de kleinere kanaaltjes. Multipele papillomen hebben een iets verhoogde kans op maligne ontaarding.
E. Radial scar
Door de goed functionerende mammografische screening gebeurt het dat de radioloog een stervormig letsel ziet op mammografie. Dit letsel kan er uitzien als een kwaadaardige tumor met uitlopers. In werkelijkheid is het bindweefsel die het omgevend weefsel wat aantrekt waardoor strengen ontstaan.
F. Goedaardige microcalcificaties
Dit zijn kleine verkalkingen in de borst die meestal toevallig gevonden worden op een mammografie. De radioloog is dikwijls in staat op radiografie vast te stellen of het om een al of niet goedaardig letsel gaat. Zij ontstaan dikwijls door stilstaan van melk in de gangen en het resulterende verkalkingsproces van het lichaam. In geval van twijfel dienen alle verkalkingen steeds gebiopsieerd te worden.
G. Vetnecrose
Dit zijn meestal erg kleine maar soms ook grotere zones waar het vetweefsel afgestorven is na onderbreking van de lokale doorbloeding. Dit gebeurt meestal na een lokaal trauma zoals een verkeersongeval.
III. Kwaadaardige tumoren
A. Risicofactoren borstkanker
Borstkanker is de derde meest frequente tumor wereldwijd en de meest voorkomende kanker bij vrouwen. De ziekte is verantwoordelijk voor 23 % van alle kankers bij vrouwen.
In België krijgen ongeveer 10500 vrouwen per jaar borstkanker, wereldwijd zijn dat er ongeveer 1,5 miljoen. Eén vrouw op 9 zal tijdens haar leven geconfronteerd worden met de ziekte. De laatste 30 jaar zien we een groeiende incidentie van borstkanker, maar het goede nieuws is dat toch het aantal overlijdens door borstkanker daalt. Dit dankzij doorgevoerde screening en betere behandelingsmogelijkheden.
Risicofactoren voor het ontwikkelen van borstkanker zijn:
Geslacht: Vrouw zijn is de voornaamste risicofactor, maar toch kan borstkanker ook bij mannen voorkomen. Op 135 patiënten is er 1 man met borstkanker.
Leeftijd: Borstkanker komt voornamelijk voor na de leeftijd van 55 jaar, maar kan ook veel vroeger voorkomen, vanaf de leeftijd van 30-35 jaar. Deze zeer jonge patiënten zijn eerder een uitzondering.
Hormonale factoren: Algemeen kan men stellen dat hoe langer het lichaam blootgesteld wordt aan de invloed van het vrouwelijk hormoon oestradiol, hoe hoger het risico op borstkanker. Dit wil zeggen:
een vroege puberteit
een late menopauze
een late eerste zwangerschap of nullipare vrouwen
het innemen van orale contraceptiva: Het is niet voldoende bewezen dat het gebruik van orale contraceptie het risico op borstkanker zou doen toenemen. Globaal kan men aannemen dat het gebruik van de huidige, laaggedoseerde pil veilig is, voornamelijk indien er geen verhoogd familiaal risico op borstkanker aanwezig is.
hormonale substitutietherapie na de menopauze: synthetisch hormonen zullen het risico op borstkanker minimaal verhogen. Natuurlijke hormonen, die we hier in Vlaanderen voorschrijven zijn veilig voor de borst.
langdurig geven van borstvoeding zou het risico eerder verlagen
Voorafbestaande geschiedenis van kanker: vrouwen met een voorafbestaande eierstokkanker hebben een verhoogd risico op het ontwikkelen van borstkanker
Vroeger doorgemaakte borstkanker: vrouwen die reeds borstkanker hebben doorgemaakt hebben een verhoogde kans op een contralateraal borstcarcinoom. Deze vrouwen moeten dus levenslang gescreend worden. Risicofactoren zijn: optreden van borstkanker op jonge leeftijd, familiaal mammacarcinoom, de aanwezigheid van in situ kankers ( niet-invasieve kankers).
Ioniserende stralen: Blootstelling aan ioniserende stralen op jonge leeftijd ( <30 jaar) of vroegere bestraling voor lymfomen, vb Ziekte van Hodgkin.
Matig alcoholgebruik: Dagelijks alcoholgebruik kan het risico doen stijgen met 40%, maar is afhankelijk van familiale voorgeschiedenis en dieetfactoren.
Familiaal voorkomen van borstkanker: 85 % van de patiënten hebben geen familiale voorgeschiedenis van borstkanker. Bij aandoening van eerste-graadsverwanten ( moeder, zus, dochter) is het risico aanzienlijk verhoogd (2x). 5-10% van alle borstkankers zijn erfelijk bepaald. Bij deze families komt borstkanker zeer frequent voor, en vaak op jonge leeftijd. Hier kan dikwijls een dominant erfelijke factor worden aangetoond (BRCA1, BRCA2 gen).
B. Onderzoek
Door vroegtijdige opsporing kan borstkanker in een vroeg stadium worden herkend. Daardoor kan de sterfte aan borstkanker dalen. Volgende methoden worden gebruikt:
Borstzelfonderzoek: Een belangrijk aandeel van de borstkankers wordt vastgesteld door de vrouw zelf. Daarom is het belangrijk dat vrouwen zelf hun borsten regelmatig onderzoeken. Het beste tijdstip voor premenopausale vrouwen is 5-7 dagen na de menstruatie, voor postmenopausale vrouwen een vaste dag elke maand. Hoe zelf een borstonderzoek te doen wordt uitgebreid op het internet uitgelegd
Klinisch onderzoek door een arts: Vanaf de leeftijd van 40 jaar wordt een klinisch onderzoek door een arts aangeraden om de 2 jaar.
Mammografie: Bij een screeningsmammografie kan borstkanker in een zeer vroegtijdig stadium worden vastgesteld, lang voor hij klinisch voelbaar of zichtbaar wordt. Het is duidelijk dat kleinere tumoren een veel betere prognose hebben. Bovendien is de behandeling van zeer kleine tumoren dikwijls minder ingrijpend, en is een lastige nabehandeling met bijvoorbeeld chemotherapie niet altijd nodig.
Aanbevelingen voor screening mammografie:
rond 40 jaar: baseline mammografie
40-49 jaar: elk jaar vergezeld door een klinisch onderzoek door uw arts
≥ 50 jaar: elk jaar vergezeld door een klinisch onderzoek door uw arts, geen limiet qua leeftijd
C. Diagnose
Elk gezwel of verandering in de borst, de tepel of de oksel moeten verder worden onderzocht. Hiervoor worden volgende onderzoeken gebruikt:
Vooreerst anamnese en klinisch onderzoek
Mammografie, meestal aangevuld met echografie van de borsten
Echografie van de borst: onderscheidt cysten van tumoren. Is meestal het enige onderzoek in adolescente vrouwen.
MRI van de borsten (Magnetische resonantie onderzoek): Bij twijfel zal in een aantal gevallen een bijkomende MRI van de borsten noodzakelijk zijn. Dit onderzoek kan soms meer informatie geven over de aard van het letsel, de lokalisatie of de uitbreiding ervan.
Fijne naald aspiratie of weefselbiopsie, eventueel onder echografische begeleiding: Onder lokale verdoving kunnen een aantal cellen of een weefselstukje uit de tumor worden verwijderd, dat verder microscopisch zal worden onderzocht. Hiermee zal men meestal de diagnose borstkanker kunnen bevestigen.
Bij niet-voelbare gezwellen wordt een harpoendraad geplaatst onder radiografische controle. Deze harpoen blijft ter plaatse wanneer de patiënte naar het operatiekwartier gaat, waar de chirurg het gezwel met de harpoendraad kan verwijderen.
Bij abnormaal vochtverlies uit de tepel zal een galactografie worden uitgevoerd. Hierbij brengt de radioloog door middel van een fijn buisje contraststof in de melkgangen, waarna een mammografie wordt uitgevoerd. Zo kan men de structuur van de melkgangen bestuderen en eventuele abnormale melkgangen lokaliseren.
Bij verlies van tepelvocht kan men wat vocht opvangen op een glazen plaatje, dat verder wordt onderzocht naar de aanwezigheid van abnormale cellen of bloed.
D. Soorten kanker
Wanneer een cel aan de binnenzijde van een klierbuisje ontspoort tot een kwaadaardige cel dient er heel wat fout te gaan. Vooreerst moet de cel te snel delen. Vervolgens moet de cel ook blijven overleven. De meeste cellen die ergens ontregeld zijn gaan volgens een geprogrammeerd programma zichzelf vernietigen. Dit wordt apoptose genoemd. Deze geprogrammeerde celdood treedt niet op bij kankercellen. Vervolgens moet de cel ook de contacten met naburige cellen verbreken. De losgeslagen, snel delende cel zal zich nu gaan vermenigvuldigen. Hierdoor geraakt het volledige klierbuisje opgevuld met kwaadaardige cellen. De holte van het buisje verdwijnt en het buisje gaat zelfs zwellen. Men spreekt nu van een ‘carcinoma in situ’. Dit is een ‘niet-invasieve’ tumor met een goede prognose. Het feit dat de cellen nog omvat zitten in het klierbuisje is van kapitaal belang. De bloedvaten en lymphevaten liggen in het bindweefsel rond de klierbuisjes. Zolang de kankercellen het basaal membraan of de wand van het klierbuisje niet doorbreken kunnen de cellen zich niet verspreiden naar andere organen. Bij een volledige wegname van een carcinoma in situ kan men stellen dat er 100 % genezing is. De meeste niet-invasieve borstkankers geven een verhoogd risico voor het ontwikkelen van een invasieve kanker. Daarom is het van belang dat deze niet-invasieve kanker tijdig wordt ontdekt en adequaat wordt behandeld.
Van zodra de kankercellen gaan migreren door de wand van het klierbuisje spreekt men van een invasieve tumor. Vanaf nu kunnen de kwaadaardige cellen de bloed –en lymfevaten bereiken. De cellen gaan een gezwel vormen buiten de klierbuisjes. Ze vormen een massa die het normale verloop van het bindweefsel verstoort. Hierdoor ontstaat een massa die bij onderzoek van de borst hard aanvoelt en niet beweegbaar is. Een kwaadaardige tumor is in de regel niet pijnlijk. Vanuit de tumor kunnen cellen via de lymfevaten migreren naar de lymfeklieren van de oksel of andere gebieden rond de borst. Bij een invasieve tumor wordt bij de heelkundige benadering altijd de lymfeklieren van de oksel gedeeltelijk weggenomen en bestudeerd op eventuele uitzaaiingen.
Niet-invasieve borstkanker
Het ductaal carcinoma in situ (DCIS) en het lobulair carcinoma in situ (LCIS) zijn niet-invasieve borstkankers. Ze worden gekenmerkt door een proliferatie van kwaadaardige cellen in de borstklier en de melkgangen, zonder doorbraak van de basale membraan.
Het DCIS wordt dikwijls vastgesteld aan de hand van microverkalkingen op een mammografie. DCIS wordt een voorloper van een invasief carcinoom beschouwd en dient steeds volledig te worden verwijderd. Er zijn verschillende gradaties van kwaadaardigheid, afhankelijk van:
De aanwezigheid van necrose ( zgn. comedonecrose)
De differentiatiegraad van de cellen
De grootte van het letsel
De aanwezigheid van microcalcificaties
Het LCIS is meestal niet voelbaar en niet zichtbaar op mammografie. Het is dikwijls een toevallige vondst bij een resectie voor een ander probleem. Het LCIS komt meestal op verschillende plaatsen in de borst voor en beide borsten zijn aangetast. Het risico om een invasieve tumor te ontwikkelen indien LCIS aanwezig is bedraagt ongeveer 37%, verdeeld over beide borsten.
Invasieve borstkanker
De cellen van invasieve kankers hebben de mogelijkheid ontwikkeld om in de diepte van de weefsels door te dringen en kunnen dus wel aanleiding geven tot uitzaaiingen in lymfeklieren of andere organen. De meest frequent voorkomende types zijn:
Invasief ductaal carcinoom (IDC)( ± 75%): Deze tumor presenteert zich meestal als een harde massa in de borst en is dikwijls omgeven door DCIS.
Invasief lobulair carcinoom (ILC)( ± 5-10%): Het ILC presenteert zich dikwijls als een slecht-omlijnde verdikking van de borst en is soms moeilijk vast te stellen, aangezien mammo- en echografie niet altijd een duidelijke tumor aantonen. In 90% van de patiënten met ILC vindt men LCIS in de omgeving. Het ILC is bijna steeds sterk hormoon-gevoelig en heeft een verhoogde kans om zich in beide borsten te ontwikkelen.
Minder frequente types zijn het medullair carcinoom, mucineus of colloid carcinoom en papillair carcinoom.
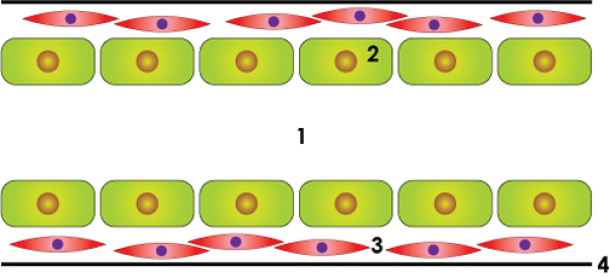
Normale melkgang
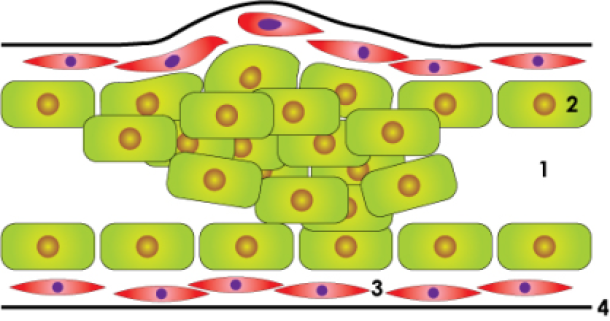
In situ carcinoom
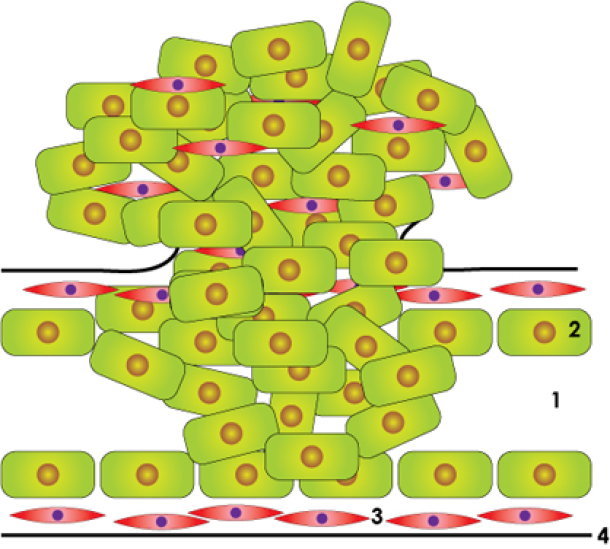
Invasief carcinoom
Bovenstaande figuur: schematische weergave van de normale melkgang, een in situ carcinoom en een invasief carcinoom: lumen of centrale holte (1), epitheelcellen (2), gladde spiercellen (3), dun vliesje of basale membraan (4).
De ziekte van Paget is een kwaadaardige aandoening ter hoogte van de borst, dewelke zich meestal presenteert als een eczeem van de tepel, met huidveranderingen ter hoogte van de tepel en soms ook ter hoogte van de huid van de borst. Aangezien deze aandoening vaak onopvallend is, en zich uit met een oppervlakkig letsel, wordt het vaak gemist. Het duidt echter op een ernstige onderliggende kwaadaardige aandoening.
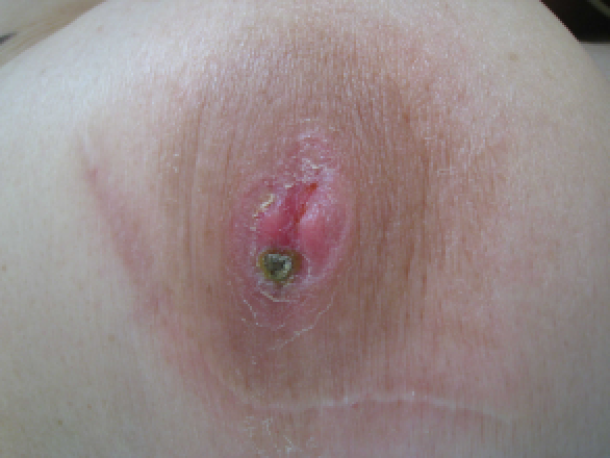
Figuur: Ziekte van Paget ter hoogte van de borst
E. Staging en prognose
Borstkankercellen kunnen zich in het lichaam verspreiden via het lymfatisch systeem, rechtstreeks via de bloedbaan of via directe ingroei in omliggende weefsels.
De lymfeknopen kunnen het eerste station zijn waar de kankercellen zich bevinden, eens ze zich van de primaire borsttumor hebben verwijderd. Deze lymfeknopen zijn gelegen in de oksel of langsheen het borstbeen. Van hieruit kunnen ze zich verder verspreiden naar het veneus systeem, en uitzaaiingen geven in verschillende organen: het skelet, longen, lever, hersenen en weke delen. Rechtstreekse uitzaaiing naar de bloedbaan is ook mogelijk.
Er wordt aangenomen dat borstkanker dikwijls reeds bij diagnose een systemische ziekte is, d.w.z. dat er zich reeds micrometastasen zouden bevinden over heel het lichaam. Vandaar de noodzaak om na een locoregionale behandeling met chirurgie en radiotherapie, ook een adjuvante, medicamenteuze therapie toe te dienen. Deze behandeling heeft als doel eventuele micrometastasen te vernietigen en zo een later herval van de ziekte te vermijden.
Bij de diagnose van borstkanker dient een goede “staging” te gebeuren: hiermee bepaalt men de uitbreiding van de ziekte. Deze staging bepaalt de prognose, en de noodzaak tot verdere adjuvante behandeling. Bij deze staging wordt gebruik van het TNM-systeem, waarbij T staat voor Tumorgrootte, N voor de status van de okselklieren (al dan niet aangetast; ‘Nodes’: lymfeklier in het Engels), en M voor de aan- of afwezigheid van Metastasen op afstand.
Tumorgrootte (T)
De tumorgrootte is gecorreleerd met prognose (hoe groter de tumor, hoe slechter de prognose), maar eveneens met de status van de okselklieren. Hoe groter de tumor, hoe groter de kans op aangetaste okselklieren. Tumoren van minder dan 1 cm hebben doorgaans een goede prognose.
Lymfeklierstatus (N)
De okselklieren zijn de voornaamste, en meestal eerste, drainageplaats voor de borst. Het aantal positieve of aangetaste okselklieren is de voornaamste prognostische factor. De betekenis van zogenaamde micrometastasen in de okselklieren (haarden van tumorcellen met een diameter < 2mm) is op dit ogenblik niet goed gekend. De onderstaande tabel toont de kansen op het ontwikkelen van een recidief naargelang de status van de oksellymfeklieren.
Aantal positieve okselklieren | Overleving zonder herval na 5 jaar | Globale 10-jaars overleving |
0 | 80% | 65-80% |
1-3 | ±60-70% | 35-65% |
4 | ±56% | 15-25% |
>4 | 18-46% | 10-20% |
Aan- of afwezigheid van metastasen op afstand (M)
Wanneer er geen aantoonbare metastasen zijn, is met een adequate locoregionale en medicamenteuze behandeling genezing mogelijk. De aantoonbare aanwezigheid van metastasen in andere organen (d.m.v. klassieke radiografische technieken, echografie van het abdomen, isotopenonderzoek van het skelet) betekent een ongeneesbare situatie. De duur en de kwaliteit van leven kunnen met een medicamenteuze behandeling nog verbeterd worden, maar definitieve genezing is uitgesloten.
Prognostische factoren zijn factoren die op het ogenblik van diagnose informatie geven over de uitkomst van de ziekte (kans op herval, kans op overlijden), en die de noodzaak tot verdere behandeling bepalen. De voornaamste zijn:
Histologische gradering: Nucleaire en histologische gradering: graad I-II-III. Hoe hoger de graad, hoe slechter de differentiatie, hoe slechter de prognose. Dit wordt bepaald door middel van het microscopisch onderzoek van het verwijderde weefsel.
Hormoonreceptorstatus (HR): Oestrogeen- en progesteronreceptoren zijn eiwitten die aanwezig kunnen zijn op de kern van de tumorcel. Bij binding van deze eiwitten met oestrogeen of progesteron (aangeboden vanuit de bloedbaan) ontstaat er een opeenvolging van signalen, die uiteindelijk aanleiding geven tot celdeling en dus, tumorgroei.
Hormoonreceptor-positieve borstklierkankers hebben een betere prognose dan hormoonreceptor-negatieve tumoren. Bovendien zijn deze receptoren een voorspellende factor voor het succes van een anti-hormonale behandeling. Bij deze behandeling wordt gepoogd de stimulerende invloed van oestrogenen op de kankercel te blokkeren.
De aanwezigheid van hormoonreceptoren wordt immuunhistochemisch bepaald en wordt uitgedrukt als een percentage positieve cellen per aanwezige borstkankercellen (0-100%). De graad van respons op een antihormonale behandeling is afhankelijk van de sterkte van aanwezigheid van deze receptoren. Hormoonreceptor-positieve tumoren komen voor in ongeveer 60% van de patiënten.
Her-2/neu receptor (c-erbB-2 receptor): De HER-2/neu of c-erbB-2 receptor is een eiwit dat in het membraan van de cel genesteld is. Wanneer groeifactoren hierop binden ontstaat er een opeenvolging van stimulerende signalen in de cel die uiteindelijk aanleiding geven tot verhoogde celdeling en tumorgroei. Overexpressie (overactiviteit of een te hoog aantal) van de HER-2 receptor vinden we in 20-25% van alle borstkankers en is meestal het gevolg van amplificatie van het HER-2 oncogen.
Overexpressie van HER-2 receptor is gecorreleerd met een agressieve kanker en met slechte prognose. Bovendien is dit een voorspellende factor voor respons op een nieuwe, “target” therapie met een antilichaam tegen de receptor, trastuzumab (Herceptine). Behandeling met trastuzumab in HER-2 positieve patiënten is nuttig in gevorderde en in adjuvante situatie. Deze behandeling kan de kans op herval met 50% verminderen!
Lymfatische en vasculaire invasie: De aanwezigheid van tumorcellen in de lymfevaten en bloedvaten van het tumorweefsel of aangetaste lymfeklieren is een maat voor agressief gedrag en is dus een slechte prognostische factor.
Leeftijd van patiënt: Jonge patiënten hebben dikwijls slecht gedifferentieerde tumoren, met negatieve hormoonreceptorstatus. Patiënten jonger dan 35 jaar worden dan ook als hoogrisicopatiënten beschouwd.
F. Aanvullende behandeling
In veel gevallen is nog een bijkomende behandeling na de heelkunde noodzakelijk. Dit wordt adjuvante behandeling genoemd. De adjuvante behandeling voor borstkanker kan bestaan uit chemotherapie, radiotherapie, een hormonale behandeling of een immunologische behandeling. Meestal wordt een combinatie van bovenstaande toegediend. Het doel van een adjuvante behandeling is circulerende kankercellen te vernietigen en zo te verhinderen dat ze zich in organen gaan nestelen en aanleiding geven tot uitzaaiingen. Deze circulerende kankercellen zijn met geen enkel onderzoek zichtbaar te maken, maar op basis van een aantal kenmerken van de borstkanker kan de kans op herval geschat worden. Uit grote internationale klinische studies weten we dat chemotherapie en hormoontherapie de kans op herval en overlijden door borstkanker met 30-40% kan doen dalen.
Chemotherapie
Bij sommige patiënten wordt een behandeling met chemotherapie voorgesteld. Hierbij wordt rekening gehouden met het individuele risico op herval. Hoe hoger de kans op herval, hoe hoger de te verwachten winst van chemotherapie.
Klassieke criteria waar men zich op baseert voor het al dan niet adviseren van chemotherapie zijn: tumorgrootte, klierstatus, hormoongevoeligheid (ER en PR), HER2-status, ki-67 (een merker voor proliferatie) en lymfovasculaire invasie. Daarnaast houdt men rekening met de leeftijd van de patiënt en diens relevante medische voorgeschiedenis.
Chemotherapie of cytostatica werken in op het genetisch materiaal van de kankercel en verhinderen aldus de celdeling en tumorgroei. Aangezien chemotherapie voornamelijk werkt op sneldelende cellen, zal er ook een invloed zijn op andere sneldelende lichaamscellen en zo aanleiding geven tot een aantal bijwerkingen. Gezonde lichaamscellen hebben echter een groter herstelvermogen dan kankercellen, zodanig dat het netto-effect van chemotherapie een vermindering is van het tumorvolume en een herstel van de beschadiging aan gezonde cellen.
Chemotherapie kan 'adjuvant' gegeven worden wat betekent dat deze behandeling start nadat de borsttumor operatief verwijderd werd. Daarentegen kan chemotherapie ook 'neo-adjuvant' gegeven worden wat inhoudt dat men eerst chemotherapie start en pas in tweede tijd overgaat naar chirurgie.
De historische standaard is de adjuvante toediening van chemotherapie. Vroeger werden enkel patiënten met grote, inoperabele borsttumoren neo-adjuvant behandeld. Het doel hierbij was de tumor te verkleinen waardoor een operatie toch mogelijk wordt.
Vandaag wordt chemotherapie meer en meer neo-adjuvant gegeven. Zeker voor wat de triple negatieve (= hormoonreceptoren negatief en HER2-negatief) en de HER2-positieve tumoren betreft. Dit heeft een aantal voordelen waarvan de belangrijkste hier kort aangehaald worden.
De respons op neo-adjuvante chemotherapie is van prognostisch belang. Patiënten bij wie de tumor mooi krimpt of zelfs volledig verdwijnt onder chemotherapie hebben een betere prognose dan patiënten bij wie dit niet het geval is. Ze hebben een kleinere kans op het ontwikkelen van metastasten op afstand en er is een betere overleving.
Er is ook een therapeutisch voordeel. Bij patiënten die geen goede respons hadden op neo-adjuvante behandeling kan de therapie uitgebreid/aangepast worden, wat een extra kans op genezing kan betekenen.
Chemotherapie kan de tumor kan verkleinen waardoor soms minder uitgebreide heelkunde nodig is met alle voordelen van dien.
Er bestaan verschillende chemotherapieschema's. De arts zal afhankelijk van het type borstkanker, het stadium, de leeftijd van patiënt en diens relevante voorgeschiedenis een voorstel doen qua behandeling. Een klassiek schema kan er als volgt uit zien: 4 cycli Epirubicine - Cyclofosfamide (welke eens in de 2 of 3 weken toegediend wordt) gevolgd door 12 wekelijkse toedieningen van Paclitaxel.
Doorgaans wordt deze behandeling intraveneus ( via een infuus) toegediend, alhoewel de laatste jaren ook in sommige gevallen een behandeling met tabletten mogelijk is. De kuren worden op regelmatige tijdstippen herhaald, bijvoorbeeld om de 3-4 weken, voor een bepaald aantal cycli (bvb. 6).
De voornaamste bijwerkingen van chemotherapie zijn:
Misselijkheid en braken
Onderdrukking van het beenmerg en dus verhoogde vatbaarheid voor infecties
Haarverlies, nagelafwijkingen
Mond- en oogslijmvliesontsteking
Lokale reacties op de plaats van inspuiting
Vermoeidheid
Invloed op de vruchtbaarheid en menstruatie
Blaasontsteking en urineverkleuring
Specifieke orgaantoxiciteit t.h.v. het hart, de longen, de lever, de nieren, het zenuwstelsel. Deze toxiciteit is zeer specifiek voor een beperkt aantal producten.
Uw arts zal er steeds rekening mee houden in functie van uw lichaamsoppervlakte, uw algemene toestand en onderliggend lijden. Soms zal het nodig zijn om dosisverminderingen door te voeren of bepaalde producten uit het schema weg te laten.
Radiotherapie
Meestal zal na heelkunde voor borstkanker ook bestraling of radiotherapie worden toegediend. Radiotherapie is een lokale behandeling die de kans op weerkeren van de tumor vermindert. De bestraling gebeurt thv. de borst, of in geval van borstamputatie, thv. de thoraxwand. Soms moet er daarbij een extra dosis of boost toegediend worden op het tumorbed. Indien de okselklieren zijn aangetast, kan het nodig zijn ook de oksel mee te bestralen.
Naargelang het voorgestelde behandelingsschema, wordt de bestralingssessie ofwel dagelijks ofwel om de andere dag gegeven. Waar een behandeling vroeger tot 7 weken kon duren, is deze inmiddels verkort tot maximaal 2 à 3 weken. Studies toonden immers aan dat er veilig een hogere dosis per keer kan worden toegediend. Bovendien kan de boost nu tegelijk met de rest van de bestraling gebeuren (simultaan geïntegreerde boost), en hoeft deze dus niet meer achteraf toegevoegd te worden.
Door de verbeterde technieken zijn nevenwerkingen zoals verbranding zeer sterk verminderd. In minder dan 10% van de patienten wordt nog ‘vochtige desquamatie’ ofwel verbranding gezien. Bovendien gaat dat over kleine regio’s, heel anders dan de uitgebreide verbrandingen van vroeger. Algemene vermoeidheid, roodheid van de huid en zwelling van de borst kunnen nog optreden. Tot jaren na bestraling kan er verlittekening of fibrose optreden, waardoor de borst vaster aanvoelt of in volume verkleint. Ook de huid kan verkleuren. Dosis thv. hart en longen wordt zo laag mogelijk gehouden, zowel door de bestralingstechnieken als door een aangepaste bestralingshouding, om schade aan deze organen te vermijden.
Net zoals heelkunde van de oksel en chemotherapie, kan bestraling van de oksel lymfoedeem van de arm veroorzaken. Zowel voor de preventie als voor de behandeling van lymfoedeem kan je terecht in de lymfekliniek, een multidisciplinaire samenwerking tussen gynaecologen, plastische en reconstructieve chirurgen, vaatchirurgen, radiotherapeuten en kinesisten.
Hormonale behandelingen
Borstkanker ontstaat uit oorspronkelijk normale borstepitheel cellen die zich abnormaal gaan gedragen. Het is dan ook logisch dat de meeste borstkankercellen nog veel eigenschappen hebben van de oorspronkelijke borstepitheelcellen. Zo hebben meer dan tachtig procent van de borstkankers oestrogeen receptoren. Dit wil zeggen dat als er oestrogenen aanwezig zijn de borstkankercellen sneller zullen delen.
Dit is natuurlijk iets wat we niet willen. Daarom zal men na de heelkunde en radiotherapie bij deze oestrogeen gevoelige tumoren ‘anti-oestrogenen’ geven. Deze anti-oestrogenen zijn stoffen die de cel deling afremmen. Omdat het altijd kan dat er reeds voor het ontdekken van de tumor, kankercellen zijn los gekomen en zich via de lymfebanen en bloedvaten hebben verspreid in het lichaam, zullen we na de heelkunde ‘anti-oestrogenen’ toedienen. Zo remmen we de groei van kleine groepjes kankercellen af in het lichaam. Zo geven we het lichaam de tijd om deze groepjes cellen aan te vallen en te vernietigen. Doen we dit niet dan zullen deze kankercellen zich organiseren tot grotere groepen van kankercellen en spreken we van metastasen of uitzaaiingen.
Deze ‘anti-oestrogenen’ noemt men hormoonbehandeling. Het zou eigenlijk correcter zijn om het een ‘anti-hormoon’ behandeling te noemen. Maar omdat het zo gebruikelijk is geworden zullen we nu ook spreken van hormoonbehandeling. Deze behandeling wordt standaard vijf jaar gegeven na de heelkunde.
De meest gekende behandeling is tamoxifen (Nolvadex-d®, of een generisch product met tamoxifen 20 mg). Deze stof is te vergelijken met een sleutel die op het zelfde slot past als natuurlijk oestrogeen. Daardoor bezet tamoxifen het slot en kan oestrogeen niet meer werken en valt de celdeling van de kankercel stil. Standaard wordt deze stof vijf jaar gegeven. Wanneer de kanker zeer agressief is (hoge delingsgraad of KI-index) of wanneer de tumor al ver gevorderd is bij het ontdekken van het gezwel (grote tumoren, of tumoren met inname van verschillende klieren in de oksel) zal tamoxifen tien jaar worden toegediend. Meestal wordt tamoxifen goed verdragen. Soms, het is immers een ‘anti-oestrogeen’, zullen klachten optreden zoals: gewichtstoename, stijfheid van de gewrichten, vermoeidheid, warmteopwellingen, droogheid ter hoogte van de vagina.
Een andere manier om de werking van de oestrogenen tegen te gaan is gewoonweg de aanmaak van oestrogenen te onderbreken. Oestrogenen worden gemaakt uit hun voorloper: het mannelijk hormoon ‘testosteron’. Het enzym dat mannelijk hormoon omzet in vrouwelijk hormoon heet ‘aromatase’. Een aromatase inhibitor werkt het aromatase enzym tegen. Hierdoor wordt totaal geen vrouwelijk hormoon meer aangemaakt door het lichaam. De stof wordt enkel gegeven bij vrouwen die in de menopauze zijn. Voor de menopauze is de productie van oestrogenen nog te overvloedig en zijn de aromatase inhibitoren niet voldoende werkzaam. Na de menopauze is er enkel nog in bepaalde weefsels en in de borstkankercellen lokale productie van oestrogeen. Die beperkte aanmaak wordt wel volledig onderdrukt door aromatase inhibitoren.
Aromatase inhibitoren worden standaard vijf jaar gegeven. Net zoals bij tamoxifen worden bij uitgebreide kankers de inhibitoren langer dan vijf jaar gegeven. En net zoals bij tamoxifen zijn er ook bijwerkingen zoals: gewichtstoename, stijfheid van de gewrichten, vermoeidheid, warmteopwellingen, droogheid ter hoogte van de vagina, botontkalking. Soms zijn de bijwerkingen zo sterk dat er wordt beslist om aromatase inhibitoren te vervangen door tamoxifen. Dit is veilig indien de vrouw probeert om de aromatase inhibitoren drie jaar te nemen. Aromatase inhibitoren zullen ook de botafbraak bevorderen waardoor osteoporose kan ontstaan. In de menopauze zal bij inname van een aromatase inhibitor of bij inname van tamoxifen worden aangeraden om een botdensitometrie te doen. Er wordt ook aangeraden om botversterkende middelen te nemen.
Bij jonge vrouwen zal men bij uitgebreide tumoren, de bron van oestrogeen aanmaak, namelijk de eierstokken, weg te nemen of stil te leggen. Chemische castratie kan door maandelijkse inspuitingen de hypofyse stil leggen. Hierdoor stopt de eierstok met vrouwelijk hormoon aan te maken. Bijkomend kan dan nog een aromatase inhibitor worden gegeven. De combinatie van deze twee behandelingen is erg belastend.
Wanneer de basis behandelingen zoals tamoxifen of aromatase inhibitoren niet meer werken en er dus een herval is onder deze producten, kunnen nog andere ‘anti-hormonale’ producten worden toegediend. Bepaalde stoffen zullen het slot voor het oestrogeen vernietigen. Anderzijds zullen bepaalde antilichamen of kleine moleculen die cel-ontregelend werken worden toegediend tijdens anti-hormonale behandeling. Dit is nog een verdere lijn van behandeling wanneer er een herval.
Adjuvante immuuntherapie
HER2-gerichte therapie
Ongeveer 20% van de patiënten met borstkanker heeft HER2-positieve ziekte. HER2 is een eiwit dat tot expressie gebracht wordt op het celmembraan. Bij patiënten met HER2-positieve borstkanker wordt er veel meer HER2 tot expressie gebracht dan gebruikelijk. Dit zorgt ervoor dat de kankercellen snel groeien en delen. HER2-positieve borstkanker is dan ook geassocieerd met een agressief verloop en een slechtere prognose bij patiënten die geen (neo-)adjuvante behandeling krijgen. Dit maakt dat patiënten met HER2-positieve borstkanker bijna steeds behandeld worden met chemotherapie in combinatie met HER2-gerichte therapie (wat de prognose aanzienlijk verbetert).
Trastuzumab (Herceptine®) is een monoclonaal antilichaam gericht tegen HER2. Bij HER2-positieve borstkanker wordt het vaak geassocieerd aan de behandeling met chemotherapie. Het wordt eens in de 3 weken subcutaan toegediend voor een totale behandelingsduur van 1 jaar. Meestal wordt het uitstekend verdragen. De belangrijkste bijwerking is een daling in de pompfunctie van het hart. Meestal is dit asymptomatisch en zien we een spontaan herstel mits het onderbreken van de behandeling.
Pertuzumab (Perjeta®) is een ander monoclonaal antilichaam gericht tegen HER2. Het kan geassocieerd worden aan de behandeling met trastuzumab bij patiënten waarbij er ook kankercellen in de okselklieren teruggevonden worden.
Trastuzumab-Emtansine (Kadcyla®) is een derde product. Het is een ‘antibody drug conjugate’. Dit betekent dat het een antilichaam is (in dit geval Trastuzumab) welke verbonden is aan een bepaald soort chemotherapie (in dit geval Emtansine). Momenteel wordt het gebruikt bij vrouwen bij wie na neo-adjuvante behandeling (chemotherapie met trastuzumab en al dan niet pertuzumab) nog tumorcellen worden teruggevonden bij de operatie. Trastuzumab-Emtansine wordt eens in de drie weken intraveneus toegediend, meestal voor 14x in totaal. Het wordt vaak goed verdragen. De meest voorkomende bijwerkingen zijn een daling van de bloedplaatjes, een stijging van de leverwaarden in het bloed, tintelingen in vingers en tenen, vermoeidheid en gastro-intestinale ongemakken.
G. Opvolging
Na het beëindigen van de volledige behandeling voor borstkanker zal een strikte follow-up gebeuren om recidieven tijdig op te sporen.
Meestal wordt volgend schema gevolgd:
Jaar 1-2: om de 3 maand
Jaar 2-5: om de 6 maand
Vanaf 5 jaar: om het jaar
De follow-up bestaat uit een klinisch onderzoek en een jaarlijkse mammografie. Indien nodig worden ook bloedafnames of andere radiologische onderzoeken aangevraagd.
Bij het vaststellen van een recidief in de borst, na borstsparende heelkunde, zal meestal een borstamputatie worden uitgevoerd, met goede kansen op genezing. Het uitvoeren van bloedcontroles, radiografie van de longen, echografie van de lever en botscan zijn zeer controversieel. Oudere klinische studies tonen geen winst in overleving bij patiënten bij wie deze onderzoeken regelmatig werden uitgevoerd. Dit is gedeeltelijk te verklaren door een gebrek aan efficiente behandeling voor uitzaaiingen van borstkanker. Tegenwoordig zijn er echter nieuwe en zeer afdoende middelen voorhanden, die de overleving van deze patiënten wel veel verbeteren. Daarom kan een meer uitgebreid onderzoek van sommige patiënten wel verantwoord en nuttig zijn. Tumormerkers opsporen in het bloed zijn niet waardevol om een recidief op te sporen.
H. Terugkerende uitzaaiingen
Eens er uitzaaiingen of metastasen in andere organen zijn opgetreden, is definitieve genezing helaas niet meer mogelijk. Dan wordt chemotherapie of hormoontherapie toegediend met als bedoeling het tumorvolume te verkleinen en zo de overleving van patiënten te verlengen en de levenskwaliteit te verbeteren.
Uitzaaiingen van borstkanker kunnen optreden in alle organen van het lichaam. De meest voorkomende plaatsen zijn bot, lever, longen, huid en lymfeklieren. Deze uitbreiding van de ziekte kan vervelende klachten veroorzaken zoals pijn, kortademigheid, misselijkheid, braken, zwakte. Indien de behandeling een vermindering van de tumormassa kan induceren, kan een aanzienlijke verbetering van deze klachten worden bekomen, met een verbeterde levenskwaliteit en verlenging van het leven als gevolg.
Een lokaal recidief in de borst daarentegen, betekent niet noodzakelijk een ongeneesbare situatie. In dat geval wordt meestal een borstamputatie uitgevoerd. Indien er geen uitzaaiingen in andere organen worden vastgesteld, zijn de genezingskansen nog reëel.
I. Borstkanker bij mannen
Alhoewel zeldzaam komt borstkanker ook bij mannen voor. Van alle borstkankers komt slechts 0,7 % bij mannen voor. De gemiddelde leeftijd waarop de diagnose wordt gesteld is 65 jaar. Een voorgeschiedenis van niet-ingedaalde teelbal, infertiliteit of zeldzame erfelijke afwijkingen behoren tot de risicofactoren. Borstkanker bij de man wordt op dezelfde manier onderzocht en behandeld als bij de vrouw.
De volgende video toont een goed voorbeeld van een man na mastectomie voor borstkanker:
